Bactérias implantadas em fungos oferecem pistas sobre as origens da vida complexa

Uma célula vegetal contendo cloroplastos (verde escuro) – organelas especializadas que os cientistas acreditam que evoluíram de endossimbiontes.Crédito: Dr. David Furness, Keele University/Science Photo Library
Cientistas empunhando uma minúscula agulha oca – e uma bomba de bicicleta – conseguiram implantar bactérias numa célula maior, criando uma relação semelhante àquelas que desencadearam a evolução da vida complexa.
A façanha - descrita1 em Natureza em 2 de Outubro — poderá ajudar os investigadores a compreender as origens dos pares que deram origem a organelos especializados chamados mitocôndrias e cloroplastos, há mais de mil milhões de anos.
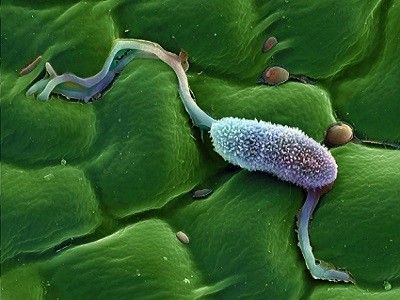
Os fungos pegaram emprestado o gene bacteriano repetidas vezes
As relações endossimbióticas – nas quais um parceiro microbiano vive harmoniosamente dentro das células de outro organismo – são encontradas em inúmeras formas de vida, incluindo insetos e fungos. Os cientistas pensam que as mitocôndrias, organelas responsáveis pela produção de energia das células, evoluíram quando uma bactéria passou a residir dentro de um ancestral das células eucarióticas. Os cloroplastos surgiram quando um ancestral das plantas engoliu um microrganismo fotossintético.
Determinar os factores que formaram e sustentaram estes acoplamentos é difícil porque ocorreram há muito tempo. Para contornar este problema, uma equipe liderada pela microbiologista Julia Vorholt, do Instituto Federal Suíço de Tecnologia de Zurique (ETH Zurique), passou os últimos anos projetando endossimbioses em laboratório. A abordagem deles usa uma agulha de 500-1000 nanômetros de largura para perfurar as células hospedeiras e, em seguida, entregar as células bacterianas, uma de cada vez.
Simbiose desencadeante
Mesmo com esta magia técnica, os pares iniciais tendiam a falhar; por exemplo, porque o pretenso simbionte se dividiu muito rápido e matou seu hospedeiro2. A sorte da equipe mudou quando eles recriaram uma simbiose natural que ocorre entre algumas cepas de um fungo patógeno de planta, Rhizopus microsporuse a bactéria Mycetohabitans rhizoxinicaque produz uma toxina que protege o fungo da predação.
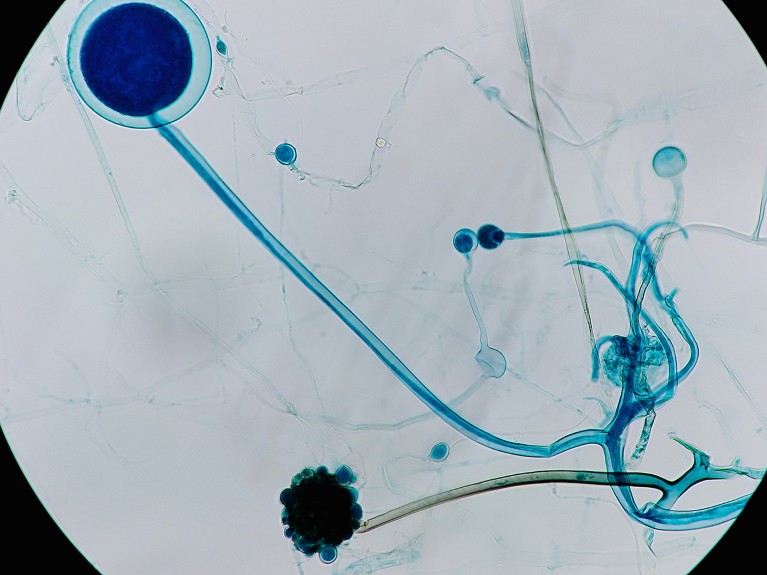
Pesquisadores implantaram bactérias em Rizopo fungos – vistos aqui ao microscópio.Crédito: SRMY/Shutterstock
No entanto, entregar células bacterianas aos fungos, que têm paredes celulares espessas que mantêm uma pressão interna elevada, foi um desafio. Depois de perfurar a parede com a agulha, os pesquisadores usaram uma bomba de bicicleta – e mais tarde um compressor de ar – para manter pressão suficiente para liberar a bactéria.
Depois de superar o choque inicial da cirurgia, os fungos continuaram o seu ciclo de vida e produziram esporos, uma fração dos quais continha bactérias. Quando esses esporos germinaram, as bactérias bem como estavam presentes nas células da próxima geração de fungos. Isto mostrou que a nova endossimbiose poderia ser transmitida aos descendentes – uma descoberta valoroso.
Bactérias em extinção
Mas o sucesso da germinação dos esporos contendo bactérias foi baixo. Numa população mista de esporos (alguns com bactérias e outros sem bactérias), aqueles com bactérias desapareceram após duas gerações. Para ver se as relações poderiam ser melhoradas, os investigadores usaram um classificador de células fluorescentes para selecionar esporos contendo bactérias – que tinham sido marcadas com uma proteína brilhante – e propagaram apenas estes esporos em futuras rondas de reprodução. Por volta de dez gerações, os esporos contendo bactérias germinaram quase tão eficientemente quanto aqueles sem bactérias.
A base desta adaptação não é clara. O sequenciamento do genoma identificou um punhado de mutações associadas ao melhor sucesso da germinação do fungo – que era uma cepa de R.microsporus não é conhecido por transportar endossimbiontes naturalmente – e não encontrou alterações nas bactérias.
A linhagem que germinou de forma mais eficiente tendeu a limitar o número de bactérias em cada esporo, diz o coautor do estudo Gabriel Giger, microbiologista da ETH Zurique. “Existem maneiras de esses dois parceiros viverem melhor e mais facilmente um com o outro. Isso é algo que é realmente valoroso para nós entendermos.”
Sistema imunológico fúngico
Os pesquisadores não sabem muito sobre a genética de R.microsporus. Mas Thomas Richards, biólogo evolucionista da Universidade de Oxford, no Reino Unido, questiona-se se um sistema imunitário fúngico está a impedir a simbiose – e se as mutações neste sistema poderão estar a facilitar as relações. “Sou um grande fã deste trabalho”, acrescenta.
Eva Nowack, microbiologista da Universidade Heinrich Heine de Düsseldorf, na Alemanha, ficou surpresa com a rapidez com que as adaptações à vida simbiótica pareciam evoluir. No futuro, ela adoraria ver o que acontece depois de períodos ainda mais longos; por exemplo, mais de 1.000 gerações.
A engenharia de tais simbioses poderia levar ao evolução de novos organismos com características úteis, como a capacidade de consumir dióxido de carbono ou nitrogênio atmosférico, diz Vorholt. “Essa é a ideia: trazer novas características que um organismo não possui e que seriam difíceis de implementar de outra forma.”
